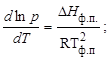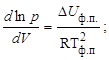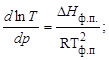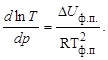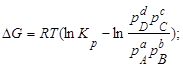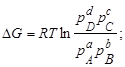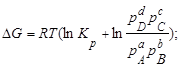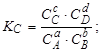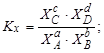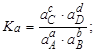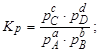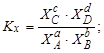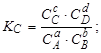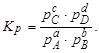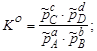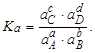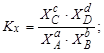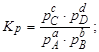Тема :: Фізична хімія
- O2(г)
- N2(г)
- H2(г)
- I2(г)
- до електродів II роду
- до електродів I роду
- до окисно-відновних електродів
- до амальгамних електродів
- H2(г), Cl2( г)
- Sn (кр), Sb (кр)
- S2(г), O3(г)
- окисно-відновний
- електрод I роду
- електродів IІ роду
- газовий
- поляризація електродів
- окиснення електродів
- гідроліз
- електроліз
- хімічна
- концентраційна
- електродна
- дифузійна
- концентраційною поляризацією
- електрохімічною поляризацією
- хімічною поляризацією
- фізичною поляризацією
- електрохімічною поляризацією
- концентраційною поляризацією
- фізичною поляризацією
- хімічною поляризацією
- методом Тьомкіна-Шварцмана;
- першим наближенням Уліха;
- другим наближенням Уліха;
- методом приведених енергій Ґіббса.
- призводить до зростання константи хімічної рівноваги
- призводить до зменшення константи хімічної рівноваги
- не впливає на значення константи хімічної рівноваги
- призводить до зменшення константи швидкості прямої реакції
- с + ф = 2
- с + ф = 3
- с + ф = к + 1
- с + ф = 4
- хімічні джерела струму
- фізичні джерела струму
- природні джерела струму
- сонячні джерела струму
- вторинних ХДС
- первинних ХДС
- паливних елементів
- третинних ХДС
- паливні елементи
- первинні ХДС
- вторинні ХДС
- акумулятори
- густина струму
- енергія активації
- електродний потенціал
- площа електродів
- пара порівняно з рідиною збагачена більш летким компонентом, тобто компонентом, додавання якого до системи збільшує її загальний тиск
- пара порівняно з рідиною збагачена більш летким компонентом, тобто компонентом, додавання якого до системи зменшує її загальний тиск
- пара порівняно з рідиною збагачена менш летким компонентом, тобто компонентом, додавання якого до системи збільшує її загальний тиск
- пара порівняно з рідиною збагачена менш летким компонентом, тобто компонентом, додавання якого до системи зменшує її загальний тиск
- кількості частинок розчиненої речовини
- природи розчиненої речовини
- агрегатного стану розчиненої речовини
- природи розчинника
- природи розчинника
- концентрації розчину
- природи розчиненої речовини
- температури навколишнього середовища
- не спостерігається виділення чи поглинання теплоти і не змінюється об’єм, тоді як зміна ентропії є такою ж, як і при змішуванні ідеальних газів
- спостерігається тепловиділення і змінюється об’єм, зміна ентропії є такою ж, як і при змішуванні ідеальних газів
- спостерігається зміна об’єму, тоді як ентропія залишається незмінною та відсутнє тепловиділення чи теплопоглинання
- не спостерігається виділення чи поглинання теплоти і не змінюється об’єм та ентропія
- в якому розчинник підкоряється закону Рауля, а розчинена речовина – закону Генрі
- усі компоненти якого підпорядковуються закону Генрі
- усі компоненти якого підпорядковуються закону Рауля
- при змішуванні компонентів якого спостерігається виділення чи поглинання теплоти і змінюється об’єм та ентропія
- будь-якої екстенсивної властивості розчину за кількістю цього компонента за умови постійності кількостей всіх інших компонентів, тиску і температури
- будь-якого термодинамічного потенціалу за кількістю цього компонента за умови постійності кількостей всіх інших компонентів, тиску і температури
- будь-якої інтенсивної властивості розчину за кількістю цього компонента за умови постійності кількостей всіх інших компонентів, тиску і температури
- будь-якої екстенсивної властивості розчину за кількістю цього компонента за умови постійності кількостей всіх інших компонентів, об’єму і ентропії
- будь-якого термодинамічного потенціалу за кількістю окремого компонента за постійності кількостей всіх інших компонентів та природних змінних потенціалу
- будь-якого термодинамічного потенціалу за кількістю цього компонента за постійності кількостей всіх інших компонентів, тиску і температури
- будь-якого термодинамічного потенціалу за кількістю цього компонента за постійності кількостей всіх інших компонентів, тиску і ентропії
- від будь-якої інтенсивної властивості розчину за кількістю цього компонента за постійності кількостей всіх інших компонентів, тиску і температури
- С + Ф = 3
- С + Ф = 2
- С + Ф = К + 1
- С + Ф = 4
- С + Ф = 3
- С + Ф = К
- С + Ф = К + 2
- С + Ф = 4
- точка
- лінія
- поле
- елемент простору
- залежність концентрації реагуючої речовини від часу
- залежність тиску від температури за постійного об’єму
- залежність константи швидкості від температури
- залежність температури від часу
- розділ фізичної хімії, що вивчає швидкості хімічних реакцій та механізм їх перебігу
- наука, що вивчає взаємні переходи теплоти і роботи в рівноважних системах
- наука про речовини, їх структуру та взаємоперетворення
- розділ фізичної хімії, що вивчає явища, які відбуваються на межі розділу фаз
- рівняння, що характеризує залежність швидкості хімічної реакції від концентрації вихідних речовин
- запис хімічної реакції з вказаним тепловим ефектом на 1 моль вихідного реагента або продукту реакції
- рівняння хімічної реакції, що відбувається лише в одному напрямку
- послідовність стадій, через які перебігає складна хімічна реакція
- величина, що чисельно дорівнює швидкості хімічної реакції, коли концентрації реагуючих речовин однакові і є одномолярними
- величина, що не залежить від температури, але прямо пропорційна концентраціям реагуючих речовин
- величина, яка визначається концентраціями реагуючих речовин та залежить від температури
- величина, що за постійної температури прямо пропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють стехіометричним коефіцієнтам
- концентрація реагуючих речовин
- природа реагуючих речовин
- температура
- всі перелічені фактори
- в котрих багаторазово повторюється один і той самий елементарний акт перетворення
- які відбуваються в декілька стадій
- які одночасно відбуваються в двох протилежних напрямках
- прискорення яких досягається за рахунок кінцевих або проміжних продуктів реакції
- найменше число частинок, яке достатнє для того щоб відбулося елементарне хімічне перетворення
- показник степеня біля концентрації в кінетичному рівнянні однієї з вихідних речовин, що бере участь в реакції
- похідну від концентрації речовини по часу
- величину константи швидкості реакції
- показник степеня біля концентрації однієї з вихідних речовин в основному кінетичному рівнянні
- cуму показників степенів біля концентрацій всіх вихідних речовин в кінетичному рівнянні
- молекулярність реакції
- суму всіх стехіометричних коефіцієнтів у рівнянні реакції
- суму показників степенів біля концентрацій всіх вихідних речовин в основному кінетичному рівнянні
- суму стехіометричних коефіцієнтів у хімічному рівнянні біля продуктів реакції
- показник степеня біля концентрації однієї із вихідних речовин в основному кінетичному рівнянні
- суму усіх стехіометричних коефіцієнтів у хімічному рівнянні
- порядок реакції може бути нульовим, цілочисельним або дробовим
- реакціями нульового порядку називають такі реакції, у яких швидкість хімічної реакції не залежить від концентрації реагуючих речовин
- молекулярність і порядок реакції не співпадають для простих реакцій
- за великої кількості води
- незалежно від кількості води
- за співмірних кількостей речовини води і естеру
- за незначної кількості води
- про здатність системи віддавати електрони
- про її стійкість у розчині
- про здатність системи легко приєднувати електрони
- компенсації
- стандартів
- кондуктометрії
- фотометрії
- хінгідронний
- каломельний
- амальгамний
- хлорсрібний
- специфічний основний
- ферментативний
- загальний основний
- загальний кислотний
- специфічний кислотний
- основи Шиффа
- кислоти Льюїса
- основи Льюїса
- кислоти Бренстеда
- основи Бренстеда
- кількість тепла, яку треба затратити для того, щоб нагріти тіло на 1°С за умови відсутності корисної роботи
- кількість тепла , яку треба затратити на охолодження тіла
- кількість тепла, яку треба затратити для того, щоб нагріти тіло на 1°С за умови виконання корисної роботи
- кількість тепла, яку отримує система від навколишнього середовища, витрачається на зміну її внутрішньої енергії і на виконання нею корисної роботи
- теплота не може самочинно переходити від менш гарячого тіла до більш гарячого
- самочинні процеси супроводжуються зменшенням теплової енергії або теплорозсіянням
- здійснення вічного двигуна другого роду неможливе тому, що неможливо створити таку періодично діючу машину, яка б перетворювала всю теплоту в роботу, тобто без передачі частини теплоти холодильнику
- енергія не виникає з нічого і не зникає безслідно
- кількість тепла, яку отримує система від навколишнього середовища, витрачається на зміну її внутрішньої енергії і на виконання нею корисної роботи
Тема :: Неорганічна хімія
- Cr2O3
- CrO
- CrO2
- CrO3
- NaOH i AgNO3
- KOH i NaNO3
- AgNO3 i K2SO4
- AgNO3 i Na2CO3
- N2O3
- N2O5
- NO2
- NO
- KClO3
- K2SO4
- K2СO3
- 5,6 л
- 2,8 л
- 28 л
- 11,2 л
- зростанням кількості електронів Хлору, що беруть участь у зв'язку з Оксигеном
- зростанням відстані між атомами Оксигену та Хлору
- зменшенням кількості електронів Хлору, що беруть участь у зв'язку з Оксигеном
- зменшенням енергії зв’язку між атомами Хлору та Оксигену
- бертолетової солі
- води
- повітря
- амонiаку
- амоній біхромату
- повітря
- сульфур (IV) оксид
- амоніак
- карбон (ІІ) оксид
- 0,14 г
- 0,28 г
- 1,4 г
- низькі температури плавлення
- електропровідність
- висока твердість
- усуспільнених електронів
- позитивно заряджених іонів у вузлах
- локалізації електронів
- зменшуються
- не змінюються
- слабо зростають
- зменшується
- зростає
- не змінюється
- 20 %
- 30 %
- 45 %
- 10 %
- 6,72 л
- 9,6 л
- 44,8 л
- 22,4 л
- хлор
- азот
- сірка
- кисень
- цинк
- азот
- сірка
- кисень
- HgO
- CdO
- MgO
- електронегативністю
- полярністю
- дисперсністю
- амфотерністю
- ковалентним
- іонним
- металічним
- водневим
- s-елементи і p-елементи
- p-елементи і d-елементи
- s-елементи і d-елементи
- s-елементи, p-елементи і d-елементи
- s-, p- i d-елементи
- s-елементи
- d-елементи
- s- i p-елементи
- s- i p-елементи
- s-елементи
- s-, p- i d-елементи
- p- i d-елементи
- різницю масового числа і кількості нейтронів
- суму масового числа і кількості протонів
- різницю масового числа і кількості протонів
- суму масового числа і кількості нейтронів
- різницю масового числа і кількості нейтронів
- суму кількостей протонів і нейтронів
- суму кількостей нейтронів і масового числа
- різницю кількостей протонів і нейтронів
- величина заряду ядра атома
- масове число ядра атома
- кількість нейтронів у ядрі атома
- всі відповіді неправильні
- кількістю протонів у ядрі атома
- кількістю нейтронів у ядрі атома
- масовим числом ядра атома
- всі відповіді правильні
- подібні хімічні властивості
- близькі значення атомних мас
- близькі значення порядкових номерів
- всі відповіді правильні
- кількості протонів у ядрі атома
- забарвлення відповідної простої сполуки
- поширеності у земній корі
- від металічних до неметалічних
- від неметалічних до металічних
- властивості елементів не змінюються
- алотропії
- гомології
- ізомерії
- анізотропії
- кількості електронів на зовнішньому енергетичному рівні в головних підгрупах
- кількості електронів у атомі
- відносній атомній масі
- кількості електронів на зовнішньому енергетичному рівні в побічних підгрупах
- всі типи оксидів
- основні оксиди
- кислотні оксиди
- амфотерні оксиди
- кількості енергетичних рівнів у атомі
- кількості електронів на зовнішньому енергетичному рівні
- кількості протонів у ядрі
- кількості електронів у атомі
- до атома Флуору
- до атома Гідроґену
- не зміщена взагалі
- у 200 г води
- у 300 г води
- у 100 г води
- 300 г
- 500 г
- 250 г
- 560 г
- 650 г
- 580 г
- 12,5 г
- 25,0 г
- 6,25 г
- 140 г
- 120 г
- 160 г
- 201,25 г
- 100,65 г
- 402,5 г
- 89,3 г
- 178,6 г
- 44,65 г
- 0,30
- 0,45
- 0,15
- 1,8
- 0,9
- 2,7
- 1,35
- 0,90
- 1,80
- 0,6
- 0,9
- 0,3
- 1,2
- 0,6
- 2,4
- 68
- 34
- 69
- 4
- 3
- 2
- 5
- 2
- 4
- 4
- 2
- 3
- 4
- 3
- 5
- менш електронегативними елементами
- неметалами
- більш електронегативними елементами
- елементами другого періоду
- від основних через амфотерні до кислотних
- від кислотних через амфотерні до основних
- від амфотерних через кислотні до основних
- від амфотерних через основні до кислотних
- сильними
- слабкими
- середньої сили
- однакової сили
- не реагують з водою
- реагують з водою, утворюючи слабкі основи
- реагують з водою, утворюючи слабкі кислоти
- реагують з водою, утворюючи амфотерні гідроксиди
- основами
- кислотами
- кислотними оксидами
- кислотами
- основами
- оснoвними оксидами
- кислотами та лугами
- солями
- активними металами
Тема :: Органічна хімія
- п’ять
- один
- три
- чотири
- окиснення
- полімеризації
- гідратації
- гідрогалогенування
- кумульовані
- ізольовані
- спряжені
- конденсовані
- ціаногідринний синтез
- реакція Реформатського
- окиснення
- гідроліз
- внутрішні циклічні естери гама оксикислот
- внутрішні циклічні естери бета-оксикислот
- міжмолекулярні циклічні естери альфа-оксикислот
- естери гама-оксикислот і спиртів
- суміш о- і п-ізомерів
- о-толуенсульфатна кислота
- м-толуенсульфатна кислота
- п-толуенсульфатна кислота
- фенілнітрометан
- о-нітротолуен
- м-нітротолуен
- п-нітротолуен
- фенілдіазонійхлорид
- N-нітрозоанілін
- п-нітрозоанілін
- 2-амінопропанова кислота
- альфа-амінопропіонова кислота
- альфа-аміноізовалеріанова кислота
- 3-амінопропанова кислота
- аміноетанова кислота
- амінооцтова кислота
- гліоксилова кислота
- гідроксипропіонова кислота
- біполярний іон
- іон, в якому одночасно існують два протилежних заряди
- іон із зарядом 2+
- іон із зарядом 2–
- галогеном
- оксигеном
- нітрогеном
- фосфором
- за правилом Марковнікова
- проти правила Марковнікова
- проти правила Зайцева
- за правилом Зайцева
- галогеналкани
- галогеналкени
- ароматичні галогенопохідні
- галогеноспирти
- мономолекулярне елімінування
- мономолекулярне нуклеофільне заміщення
- бімолекулярне нуклеофільне заміщення
- бімолекулярне елімінування
- гліцерол
- етиленгліколь
- пропан-1-ол
- бутан-2-ол
- синтол
- синсунол
- синусол
- синусолін
- алкоголяти
- алкоголі
- аміни
- нітрати
- взаємодія спиртів з органічними або мінеральними кислотами
- взаємодія спиртів з мінеральними кислотами
- взаємодія спиртів з амінами
- взаємодія спиртів з нітрогенвмісними органічними сполуками
- циклізація
- ізомеризація
- розщеплення карбонових ланцюгів
- хлорування
- Марковнікова
- Лєбєдєва
- Зайцева
- Меншуткіна
- розгалуженням Карбонового ланцюга
- положенням подвійних зв’язків
- положенням потрійних зв’язків
- неможлива для цих сполук
- є джерелом Карбону
- забезпечують 70 % потреб організму в енергії
- містять спадкову інформацію
- є сильними отрутами
- альдоз
- пентоз
- кетоз
- гексоз
- крохмаль
- сахарозу
- глюкозу
- диоксиацетон
- “крісла”
- “ванни”
- “твіст”
- “літака”
- гомоолігосахариди
- гетероолігосахариди
- відновлюючі
- невідновлюючі
- гексоз
- тріоз
- пентоз
- тетроз
- целюлозу
- сахарозу
- глюкозу
- глікоген
- крохмаль
- сахарозу
- целюлозу
- глюкозу
- можуть утворювати біліпідні шари
- можуть утворювати триліпідні шари
- є сильними отрутами
- транспортують кисень
- запобігають механічним пошкодженням внутрішніх органів тварин
- запобігають переохолодженю організма
- є сильними отрутами
- містять спадкову інформацію
- монокарбонові
- дикарбонові
- трикарбонові
- тетракарбонові
- мила
- фарби
- мазі
- оліфи
- нейтральні ліпіди
- кислі ліпіди
- лужні ліпіди
- амфотерні ліпіди
- гліцерофосфоліпіди
- сфінгофосфоліпіди
- стероїди
- ацилгліцероли
- парне число атомів Карбону
- лінійні карбонові ланцюги
- непарне число атомів Карбону
- нелінійні карбонові ланцюги
- вторинною структурою
- первинною структурою
- третинною структурою
- четвертинною структурою
- пептидні
- водневі
- дисульфідні
- гідрофобні
- ферменти
- антитіла
- гормони
- вітаміни
- гемоглобін
- родопсин
- трипсин
- колаген
- четвертинною структурою
- первинною структурою
- вторинною структурою
- третинною структурою
- водневі
- дисульфідні
- іонні
- гідрофобні
- електрофорез
- діаліз
- гель-фільтрація
- висолювання
- протеїди
- протеїни
- поліпептиди
- монопептиди
- первинною структурою
- вторинною структурою
- третинною структурою
- четвертинною структурою
- лактатдегідрогеназа
- гемоглобін
- інсулін
- міоглобін
- пептизація
- регенерація
- сублімація
- антикоагуляція
- інсулін
- гемоглобін
- колаген
- еластин
- діаліз
- гель-фільтрація
- електрофорез
- висолювання
- хромопротеїдів
- глікопротеїдів
- нуклеопротеїдів
- ліпопротеїдів
- полімерів
- мономерів
- тримерів
- димерів
- макроергічними
- водневими
- нуклеозидними
- іонними
- інформаційну, транспортну, рибосомальну
- інформаційну, транспортну, захисну
- інформаційну, транспортну, каталітичну
- інформаційну, структурну, каталітичну
- нуклеотид
- глюкоза
- нуклеозид
- амінокислота
- тимін
- гуанін
- цитозин
- урацил
- аденін
- гуанін
- тимін
- первинної структури ДНК
- вторинної структури ДНК
- третинної структура ДНК
- четвертинної структури ДНК
- АТФ
- АМФ
- УДФ
- ЦТФ
- природні естери гліцеролу та вищих нерозгалужених карбонових кислот
- природні естери етанолу та монокарбонових кислот
- ангідриди вищих спиртів та вищих карбонових кислот
- природні етери вищих спиртів та вищих карбонових кислот
Тема :: Аналітична хімія
- концентрації Меn+ в розчині
- тиску
- природи фонового електроліту
- рН ≈ 7, охолодження
- рН ≈ 7, нагрівання
- рН > 7
- тому що проходить окиснення ОН¯ іонів
- тому що проходить відновлення металу
- тому що проходить відновлення ОН¯
- точно відповідає максимуму спектра поглинання
- точно відповідає мінімуму спектра поглинання
- є постійною
- прозорість розчину
- інтенсивність забарвлення
- каламутність розчину
- вимірюванні поглинання, пропускання та розсіювання світла досліджуваною речовиною
- випромінювані атомів у збудженому стані
- вимірюванні радіоактивного випромінювання
- поглинання речовини поверхнею твердого тіла
- поглинання газу рідиною
- поглинання речовини поверхнею рідини
- властивість іонів заміщувати один одного в кристалі з утворенням фаз перемінного складу
- поглинання речовини поверхнею рідини
- утворення осаду
- випадання в осад сполук добуток розчинності яких ще не досягнуто
- випадання в осад сполук добуок розчинності яких досягнуто
- випадання в осад розчинних сполук
- відбувається розчинення осаду
- осад не розчиняється
- не відбувається ніяких змін
- природа розчинника та температура
- на добуток розчинності ніякі фактори не впливають
- проходження окисно-відновних реакцій
- електрохімічні
- обміну
- заміщення
- катоді
- катоді і аноді
- аноді
- виділення оксиду або солі
- виділення чистого металу
- виділення водню
- за різницею мас електрода до і після електролізу
- за законом Фарадея
- за електрохімічною реакцією
- водень
- кисень
- метал
- до полегшення розряджання іонів
- до більшого виділення металу
- до виділення водню
- менш активний метал
- більш активний метал
- метал концентрація іонів якого найбільша
- іони галогеноводних кислот
- іони кислотних залишків оксигеновмісних сполук
- катіони металів
- зміною різниці потенціалів на границі електрод-розчин
- малим значенням напруги розкладу
- великим значенням напруги розкладу
- виділенню водню
- виділенню на електроді ряду електровід’ємних металів із розчинів
- виділенню кисню
- в гальванічному елементі без зовнішнього струму
- при обов’язковому зовнішньому струмі
- взагалі без струму
- більшість гідроксидів і сульфідів металів
- карбонати
- кислоти
- старінням
- орієнтацією
- дифузією
- утворенню добре сформованих осадів
- процесу дифузії
- швидкості реакції
- 24 години
- 15 хв
- 10 годин
- нагрівання і перемішування
- зниження температури
- комплексоутворювач
- сульфатна кислота
- натрію сульфат
- амонію сульфат
- дрібнокристалічна
- аморфна
- крупнокристалічна
- для дозрівання осаду
- для повноти осадження
- для десорбції співосаджених частин
- закон еквівалентів
- закон збереження маси
- закон кратних відношень
- точкою еквівалентності
- точкою нейтралізації
- кінцевою точкою титрування
- алкаліметрія
- ацидиметрія
- комплексонометрія
- ацидиметрія
- алкаліметрія
- комплексонометрія
- показник індикатора
- показник титрування
- точка еквівалентності
- інтервал (область) переходу забарвлення індикатора
- показник індикатора
- показник титрування
- 7,9 – 9,9
- 9,9
- 7,9
- окисно-відновні
- осадження
- комплексоутворення
- значенням редокс-потенціалів
- числом прийнятих або відданих електронів
- значення ступенів окиснення
- молярна маса ділиться на 5
- молярна маса ділиться на 2
- молярна маса ділиться на 3
- Плюмбум (ІІ), Гідраргірум (І), Аргентум (І)
- Плюмбум (ІІ), Гідраргірум (ІІ), Аргентум (І)
- Аргентум (І), Плюмбум (ІV), Гідраргірум (І)
- Барію
- Калію
- Кальцію
- реакція «золостистого дощу»
- рекція з лугом
- реакція з кислотою
- розчинення осаду
- утвореня бурого осаду
- утвореня жовтого осаду
- дією гарячою води
- дією сульфатної кислоти
- дією хлоридної кислоти
- фізико-хімічні
- хімічні
- фізичні
Тема :: Колоїдна хімія
- збільшується
- зменшується
- спочатку зменшується, а потім збільшується
- C8H17COOH – C5H11COOH – C2H5COOH – HCOOH
- CH3COOH – HCOOH – C3H7COOH – C5H11COOH
- CH3COOH – C3H7COOH – C4H9COOH – C8H17COOH
- у даному гомологічному ряді при збільшенні довжини вуглеводневого радикалу на групу -CH2– поверхнева активність зменшується у 3–3,5 рази
- у даному гомологічному ряді при збільшенні довжини вуглеводневого радикалу на групу -CH2– поверхнева активність зростає у 3–3,5 рази
- при збільшенні довжини вуглеводневого радикала на групу -CH2– поверхневий натяг зростає у 3–3,5 рази
- dσ/dC > 0
- dσ/dC = 0
- dσ/dC < 0
- зміна поверхневого натягу розчину при зміні концентрації речовини на одиницю
- збільшення адсорбції при зменшенні концентрації речовини на одиницю
- поверхнева енергія, що припадає на одиницю поверхні
- поверхнево-інактивних
- поверхнево-неактивних
- поверхнево-активних
- збільшиться
- зменшиться
- не зміниться
йона:
- зменшується
- не має чіткої залежності
- не змінюється
- зростає
- Панета-Фаянса
- Вант-Гоффа
- Дюкло-Траубе
- Шульце-Гарді
- розсіювання світла
- дифундування колоїдів
- об'єднання частинок в більш великі агрегати
- руху колоїдних частинок в електричному полі
- іони, заряджені протилежно гранулі
- тільки катіони
- будь-які катіони і аніони
- тільки аніони
- здатність до утворення частинок певного розміру
- стійкість до зміни поверхневого натягу
- стійкість до зміни рН
- здатність зберігати розмір часток
- здатність зберігати сталість рН
- стійкість до броунівського руху
- стійкість до переміщення частинок в електричному полі
- здатність зберігати сталість дисперсності і рівномірного розподілу часток дисперсної фази
- утворення більших агрегатів
- до зміни поверхневого натягу
- до зміни рН
- до осідання під дією сили тяжіння
- гранула
- агрегат
- ядро
- міцела
- на межі міцели з дисперсним середовищем
- на межі потенціалвизначаючих іонів і протийонів
- на межі адсорбційного і дифузійного шарів
- на межі ядра і потенціалвизначаючих іонів
наступним чином:
- зменшує стійкість
- вплив залежить від природи золю
- не змінює стійкість
- збільшує стійкість
- дисперсійного середовища
- частинок дисперсної фази
- гранули
- міцели
- частинок дисперсійного середовища
- катіонів
- частинок дисперсної фази
- аніонів
- термодинамічна нестійкість колоїдів
- співмірність розміру колоїдних частинок з довжиною хвилі світла;
- густина дисперсійного середовища
- гомогенність колоїдних розчинів
використовувати:
- реакції гідролізу
- фізико-хімічне дроблення осаду
- ультразвук
- механічне диспергування
- диспергування
- емульгування
- діалізу
- електрофорезу
- драглі, аерозолі, піни, суспензії
- золі, суспензії, емульсії, аерозолі
- піни, золи, емульсії, аерозолі
- суспензії, емульсії, піни, холодці
- суспензія
- аерозоль
- емульсія
- піна
- емульсії, піни, колоїдні розчини ВМС, аерозолі
- суспензії, колоїдні розчини ПАР, піни, золи
- золі, суспензії, емульсії, піни
- колоїдні розчини ПАР, суспензії, піни, аерозолі
- аерозоль
- золь
- емульсія
- суспензія
- гомогенні, стійкі термодинамічно і кінетично, прозорі
- гетерогенні, частинки видно в оптичний мікроскоп, каламутні, розсіюють світло
- гетерогенні, відносно нестійкі кінетично, прозорі, розсіюють світло
- гетерогенні, нестійкі кінетично і термодинамічно, каламутні
- збільшення поверхневого натягу
- збільшення вільної поверхневої енергії
- збільшення площі контакту рідини з поверхнею твердого тіла
- збільшення площі контакту газу з поверхнею твердого тіла
- Вант-Гоффа
- Юнга
- Гіббса
- Дюкло-Траубе
- Г = КСn
- Г = К + Сn
- Г = К + С1 / n
- Г = К · С1 / n
- Г = Г∞P / (1 + KP)
- Г = Г∞KP / (1 + KP)
- Г = KP / (1 + KP)
- Г = Г∞K / (1 + KP)
- досягає максимальної величини
- збільшується
- зменшується
- не змінюється
- адсорбована молекула і адсорбент можуть розглядатися як дві незалежні системи
- йде з вимірюваної швидкістю при відносно високій температурі і характеризується енергією активації
- не вимагає енергії активації
- викликається силами міжмолекулярної взаємодії
- рівністю швидкостей абсорбції і адсорбції
- рівністю швидкостей адсорбції і десорбції
- максимальною швидкістю адсорбції
- мінімальною швидкістю адсорбції
- площі поверхні адсорбенту
- концентрації розчинника
- концентрації розчиненого речовини
- температури
- це чисто фізичний процес
- цей процес не протікає самочинно
- це поглинання речовини всім обсягом твердого речовини
- це поглинання речовини на поверхні твердого тіла
- десорбції
- абсорбції
- змочування
- конденсації
- σ = σо - В · ln (1 + С)
- σ = σо - В · ln (1 + К)
- σ = σо - В · ln (1 + КС)
- σ = σо - В (1 + КС)
- Нернста
- Ленгмюра
- Шишковського
- Фрейндліха
- сахароза
- сірчана кислота
- етаналь
- гліцерин
- пропаналь, бутаналь, етаналь, пентаналь
- етанова кислота, метанова кислота, бутанова кислота
- формальдегід, етаналь, пропаналь, бутаналь
- метанол, бутанол, пропанол, етанол
- бутанола
- метанола
- води
- пропанола
- Дюкло-Траубе
- Вант-Гоффа
- Шульце-Гарді
- Шишковського
- зменшують поверхневий натяг розчину
- практично не змінюють поверхневий натяг розчинника
- зменшують поверхневий натяг розчинника
- збільшують поверхневий натяг розчинника
- бутанол, гліцерин, сахароза
- етанол, метанова кислота, гліцерин
- етанол, етаналь, масляна кислота
- метанол, сахароза, пропіонова кислота
активність (g):
- g = 0
- g = 1
- g < 0
- g> 0
- g = 0
- g = 1
- g > 0
- g < 0
- зменшують в'язкість розчинника
- знижують поверхневий натяг розчинника
- не змінюють поверхневий натяг розчинника
- підвищують поверхневий натяг розчинника
- рівний термодинамічно оборотній, ізотермічній роботі, яку необхідно виконати, щоб зменшити площу розділу фаз на одиницю
- має розмірність Дж/м2
- рівний термодинамічно оборотній, ізотермічній роботі, яку необхідно виконати, щоб збільшити площу розділу фаз на одиницю
- характеризує надлишок поверхневої енергії, що припадає на 1м2 міжфазної поверхні
- розчинника знижувати поверхневий натяг розчину
- розчинника змінювати поверхневий натяг розчину
- розчиненої речовини змінювати поверхневий натяг розчинника
- розчинника підвищувати поверхневий натяг розчину
- досягає максимального значення
- збільшується
- зменшується
- не змінюється
- E = σ + S
- E = σ / S
- E = S / σ
- E = σS
- в рідинах
- в гомогенних системах
- на межі поділу фаз
- на межі поділу газ - газ
- має надлишкову вільну поверхневу енергією
- не відрізняється за властивостями від внутрішніх шарів рідини
- володіє невеликою в'язкістю
- містить велику кількість активних молекул
- адгезія
- адсорбція
- абсорбція
- зменшення концентрації речовини в поверхневому шарі
- збільшення концентрації речовини в усьому об’ємі
- збільшення концентрації речовини на поверхні розділу фаз
- рух заряджених частинок до електродів
- хаотичний рух частинок
- рух частинок під дією сили тяжіння
- заміна розчинника
- подвійний обмін
- пептизація
- проходженням світла
- седиментацією
- електричною провідністю
- колоїдних
- ультрамікрогетерогенних
- грубодисперсних
- істинних розчинів
- нерухомими
- зв’язнодисперсними
- твердими розчинами
- структурованими
- Дж/м
- Н*м2
- Н/м2
- Н/м
- мають погано сольватовані частинки
- мають слабко виражену взаємодію між частинками дисперсної фази і розчинником
- мають сильно виражену взаємодію між частинками дисперсної фази і розчинником
- входить до складу гратки адсорбенту
- утворює з одним з iонiв сiтки добре розчинну сполуку
- утворює з одним з iонiв сiтки важкорозчинну сполуку
- 10-5 – 10-3 м
- 10-10 – 10-11 м
- >10-3 м
- 10-5 – 10-7 м
- 10-7 – 10-9 м
- діалізі й ультрафільтрації
- коагуляції
- адсорбції
- диспергації
- хлоридна кислота
- натрій гідроксид
- ізопропіловий спирт
- розчинення осаду
- хімічної конденсації
- фізичної конденсації
- дисолюційної пептизації
- розсiюється у виглядi конуса, що свiтиться
- вiдбивається
- поглинається
- зазнає заломлення
- коагуляцією
- коалесценцією
- когезією
- седиментацією
- першого
- другого
- нульового
- поріг коагуляції
- поріг седиментації
- поріг чутливості
- коагулююча здатність
- SO42−
- І−
- Cu2+
- Na+
- позитивний
- негативний
- нульовий
- електронейтральний
- спочатку нульовий, потім негативний
- синерезис
- старіння золю
- звикання золю
- зниження чутливості
- прямих
- обернених
- оборотних
- коагуляція
- коалесценція
- контракція
- солюбілізація
{m(AgCl)nAg+(n-x)NO3-}x+xNO3-, знаходяться в дифузійному шарі?
- NO3-
- AgCl
- Ag+
- AgCl та Ag+
- Ag+та Cl-
- Cl-
- позитивний
- негативний
- нейтральний
- ліофобна
- ліофільна
- гідрофільна
- вільнодисперсна
- зв′язнодисперсна
- синергізм
- адитивність
- солюбілізація